近日,Wiley-VCH旗下主打期刊Angewandte Chemie International Edition(《德国应用化学》)在线发表了高等研究院孔望清课题组在镍催化烯烃双官能团化反应领域取得的最新成果,论文标题为“Three‐Component Alkene Difunctionalization via Direct and Selective Activation of Aliphatic C‐H Bonds”,(DOI:10.1002/anie.202014632)。
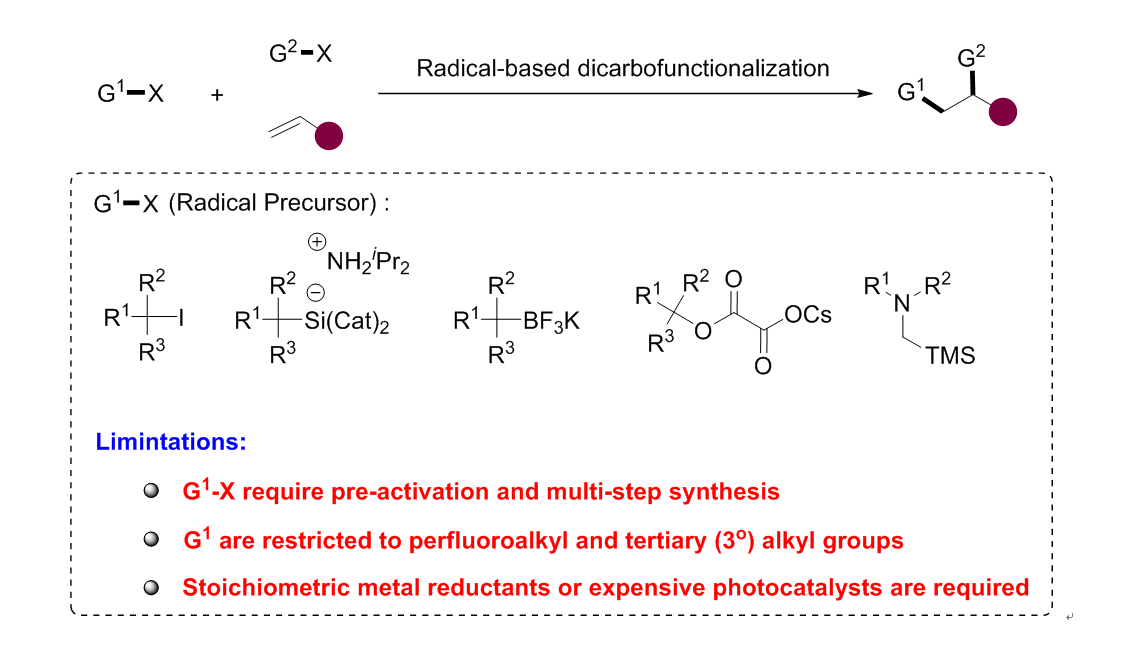
烯烃是简单易得的大宗化学品,烯烃的双官能团化反应可以快速构建复杂的分子,在有机合成中具有广泛的应用。传统过渡金属催化的烯烃双官能团化反应通常需要使用化学计量的有机金属试剂,因此限制了底物范围和反应的适用性。近年来,镍催化烯烃自由基类型的双官能团化反应取得了飞速的发展,可以使用如三级烷基卤、三级烷基硅、三级烷基硼酸盐等活化的自由基前体来代替有机金属试剂,因此具有十分广泛的官能团耐受性。尽管取得了一些成功,但是这类反应仍有较多缺陷:1. 这些自由基前体制备复杂,原子利用率低;2. 大部分反应只能兼容三级烷基自由基;3. 反应需要过量的金属还原剂或者昂贵的光催化剂。
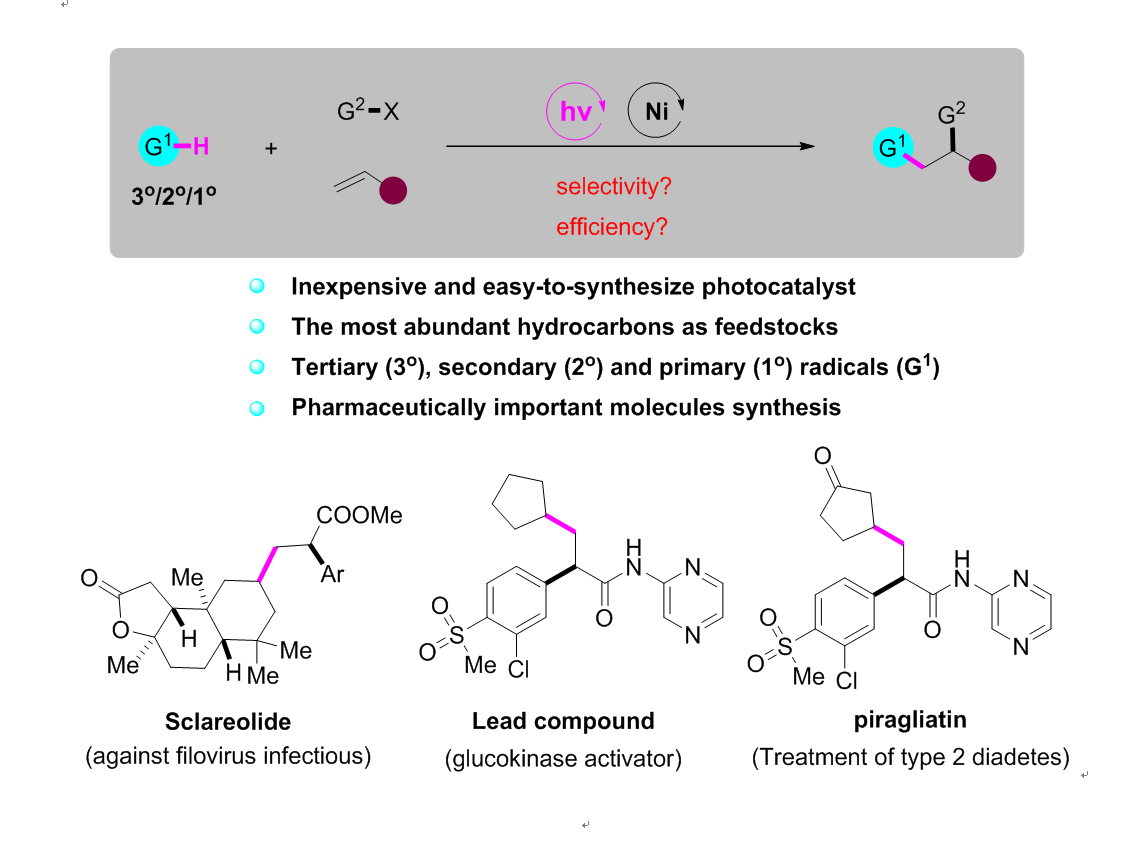
为了解决上述存在的问题,理想的策略是实现烷基C-H键直接参与的烯烃双官能团化反应。然而在无导向基团参与条件下实现高选择性的碳氢键官能团化,一直是有机化学领域非常具有挑战性的课题。近年来,廉价的光催化剂十钨酸四丁基铵(TBADT)通过氢原子转移(HAT)策略实现C(sp3)-H官能团化的反应被广泛研究,但是三组分的偶联反应还鲜有报道。武汉大学高等研究院孔望清课题组一直致力于烯烃的双官能团化反应的研究(J. Am. Chem. Soc., 2018, 140, 12364; ACS Catal. 2019, 9, 7335; ACS Catal., 2019, 9, 9127; Org. Lett., 2019, 21, 7498.),近日,该课题组通过HAT策略活化脂肪烃C(sp3)-H,实现了Ni催化的烯烃分子间烷基芳基化反应。该反应底物范围广,对三级、二级和一级烷基自由基均能很好地兼容,这是之前的方法所无法实现的。利用该反应,该课题组还实现了一系列复杂天然产物分子的后期功能化修饰;并通过三步反应实现了2型糖尿病药物分子Piragliatin的高效合成。
在最优条件下,作者对烷烃部分进行了底物范围的考察。对于普通的环状、链状以及带有桥环的烷烃,都能有着中等至良好的收率,其中1-溴丁烷以高选择性地得到三组分产物(r.r.>20:1),此外,具有缺电子基团的环戊酮能够单一地得到β位官能团化的产物。杂原子α位的C-H键同样适用该体系,值得一提的是,Boc保护的二甲胺以及叔丁基保护的甲醇首次实现该类型的三组分反应,其三组分产物可以进一步实现五元环的内酰胺以及内酯的合成。为了展现该方法学在合成上的应用价值,作者随后实现了一系列复杂天然产物的后期功能化修饰,能以良好的选择性得到三组分产物。最后,从商业可得的原料出发,该方法学仅需三步就能实现了2型糖尿病药物分子Piragliatin的合成。
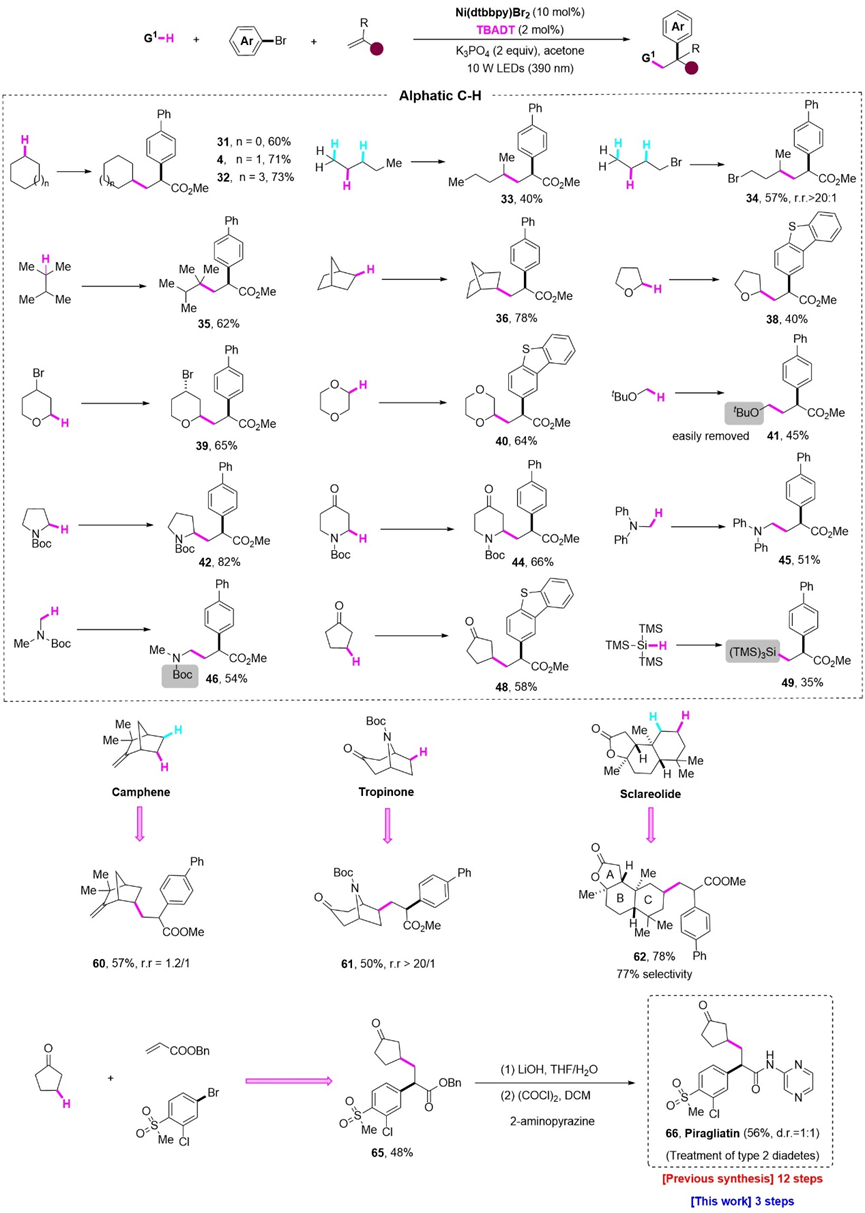
孔望清课题组成功将光-HAT的策略引入Ni催化的烯烃双官能团化的反应中。由于直接使用脂肪烃作为自由基前体,反应不仅条件温和、底物适用范围广,而且原料廉价易得、原子利用率高。同时,复杂天然产物后期功能化修饰以及Piragliatin的合成也展示了该方法学的巨大应用价值。
相关结果发表在Angew. Chem. Int. Ed.上,该论文由孔望清教授指导完成,作者为博士研究生许盛、硕士研究生陈荷蓉以及博士研究生周志俊。该研究工作得到了国家自然科学基金和武汉大学的支持。论文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202014632



 武大主页
武大主页 武大邮箱
武大邮箱 信息门户
信息门户 English
English